Tutkimusryhmä kehitti nanokokoisen voimasensorin ja paransi huipputarkkaa mikroskopiatekniikkaa

Solut ovat monissa tapauksissa hyvin aktiivisia liikkujia ja voimantuottajia. Soluissa syntyvät voimat saavat lihakset supistumaan juostessa ja hengityksen toimimaan. Solujen kyky tuottaa fyysisiä voimia onkin yksi kehon perustoiminnoista. Aikaisemmin kehitetyillä voimasensoreilla on voitu mitata jopa yksittäisten proteiinien kokemia voimia, mutta solun sisäisiä voimia ja mekaanisia venymiä ei ole voitu havaita.
Tampereen yliopiston solubiologian tutkijoiden yhdessä Ohion osavaltionyliopiston (The Ohio State University, OSU) tutkijoiden kanssa kehittämä voimasensori voidaan kiinnittää mekaanisesti venyvän proteiinin kylkeen, jolloin se aistii proteiiniin kohdistuvia voimia solun sisällä.
Mikroskooppisen pienen voimasensorin kehittäminen alkoi kokousmatkalla joulukuussa vuonna 2019.
– Eräällä illallisella saimme idean uudenlaisesta sensorista. Sensorin voimaa aistiva osa on kuin kuminauha, joka venyessään muuttaa väriä. Tämä osa kiinnitetään kuminauhan molemmissa päissä oleviin vasta-aineisiin, jotka sitoutuvat tutkittavaan solun sisäiseen kohdeproteiiniin. Proteiiniin kohdistuvan voiman tai venymän voi sitten lukea mikroskoopilla kuminauhan venymää, eli sen tuottamaan ”väriä” seuraamalla, selvittää yliopistotutkija Teemu Ihalainen Tampereen yliopiston BioMediTechistä.
Ihalaisen mukaan voimasensori, joka on kooltaan vain parikymmentä nanometriä, on helposti yleistettävissä monenlaiseen solubiologiseen tutkimukseen ja erilaisille kohdeproteiineille. Proteiinin ulkopuolisen sensorin avulla voidaan mitata voimia esimerkiksi tumakalvossa, eri proteiinien välillä tai solun tukirangassa. Sen avulla solun mekaniikka voidaan nyt ensimmäistä kertaa muuttaa näkyvään muotoon. Tätä sensoritekniikkaa kohtaan onkin ilmennyt suurta kiinnostusta jo nyt eri laboratorioissa Japanissa, Intiassa, Norjassa ja Yhdysvalloissa.
Solun sisäiset voimat antavat tietoa syövän mekaniikasta
Soluihin kohdistuu voimia koko ajan, niin normaaleissa kehon toiminnoissa kuin sairauksissakin.
Esimerkiksi syöpäsolun kasvaessa ja liikkuessa soluihin kohdistuu mekaanisia voimia. Syövän levitessä syöpäsolu joutuu puristautumaan soluväliaineessa ahtaista raoista esimerkiksi verisuoneen tunkeutuessaan. Syöpäsoluihin kohdistuu siis voimakkaita puristavia ja venyttäviä voimia, jotka voivat hajottaa osan soluista. Tumaan tulleet vauriot voivat muuttaa sen genomirakennetta, josta voi joissain tilanteissa olla jopa hyötyä syövän kehittymiselle.
– Sensorien avulla mm. syövän mekaniikkaa ja siihen liittyviä prosesseja päästään seuraamaan aivan uudesta näkökulmasta, Ihalainen toteaa.
Tutkimus Nuclear lamina strain states revealed by intermolecular force biosensor on julkaistu arvostetussa Nature Communications tiedelehdessä.
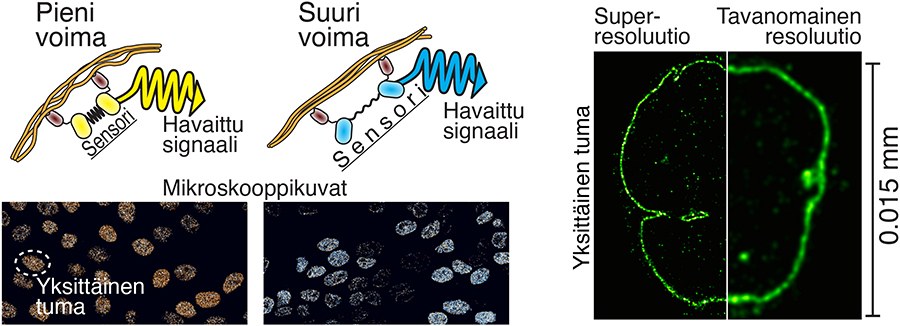
Pienetkin yksityiskohdat näkyviin superresoluutiomikroskopian avulla
Toinen tuore tutkimus jalosti ekspansiomikroskopiaa yhdistämällä solubiologian ja signaalin prosessoinnin osaamista. Tutkimukseen osallistui solubiologien ohella kuvantamisen asiantuntijoita Tampereen yliopiston tekniikan ja luonnontieteen tiedekunnasta sekä virustutkijoita Jyväskylän yliopistosta.
Valomikroskopian erotuskyvyn rajoituksena on näytteen pienten rakenteiden yksityiskohtien sumentuminen linssien ja valon vuorovaikutusten vuoksi. Erilaiset super-resoluutiomikroskopia tekniikat kuitenkin mahdollistavat hyvin pienten yksityiskohtien erottamisen. Yksi näistä tekniikoista on nk. ekspansiomikroskopia, jonka periaatteena on fyysisesti suurentaa kuvauskohdetta, esimerkiksi solua, ja siten tarkastella sen sisällä olevia pikkuruisia asioita. Käytännössä näyte valetaan pehmeään geeliin, jota voidaan laajentaa nelinkertaiseksi. Samalla se myös suurentaa kaikki näytteen yksityiskohdat.
– Ongelmana on kuitenkin ollut se, että mitä pienempiä yksityiskohtia solusta tarkastellaan, sitä vähemmän molekyylejä on näkyvillä. Tämä tarkoittaa, että näytteestä on saatu vähemmän signaaleja eli informaatiota ja kuvaan tulee paljon häiriöitä, vähän kuin lumisadetta tv-ruudulle, Ihalainen taustoittaa.
Tutkimusryhmä löysi ratkaisun solun toistuvasta fluoresoinnista eli leimaamisesta. Tutkijat keksivät leimata molekyylejä monta kertaa, jotta ne näkyisivät kirkkaampina ja informaatiota saataisiin lisää.
– Käytännössä toistuvan leimauksen avulla pumppasimme molekyyleihin enemmän fluoresoivaa ainetta, ikään kuin lisäsimme heijastimia. Yksinkertainen ja helppo menetelmä paransi huomattavasti kuvan erotuskykyä, kontrastia. Tämän lisäksi kuvista poistettiin laskennallisesti häiriöitä, mikä lisäsi kuvan terävyyttä entisestään, hän havainnollistaa.
Toisin kuin monet superresoluutiomikroskopia tekniikat, ekspansiomikroskopia ei vaadi kalliita instrumentteja ja se on helppo toteuttaa. Tutkijoiden kehittämä tekniikka on erityisen hyödyllinen todella pienien yksityiskohtien tutkimisessa. Esimerkiksi noin 120 nanometrin kokoisen Herpes viruksen rakenteen tarkastelu on mahdollista nyt jopa valomikroskoopilla. Perinteisellä valomikroskopialla virukset erottuvat vain yksittäisinä pisteinä.
Tutkimus Iterative immunostaining combined with expansion microscopy and image processing reveals nanoscopic network organization of nuclear lamina on julkaistu arvostetussa Molecular Biology of the Cell tiedelehdessä.
– Molemmat työt ovat perustutkimusta, haluamme ymmärtää miten solut pohjimmiltaan toimivat. Siksi Suomen Akatemialta saatu tutkimusrahoitus ja mahdollisuus toimia Tampereen yliopiston Tutkijakollegiumissa ovat olleen valtavan tärkeitä tekijöitä näissä hankkeissa, Ihalainen summaa.
Teksti: Anna Aatinen





