Tutkijat kehittivät solun sisällä toimivan molekyyliliiman
Tutkimus julkaistiin kansainvälisessä PNAS-julkaisusarjassa, joka kuuluu maailman arvostetuimpiin tiedejulkaisuihin.
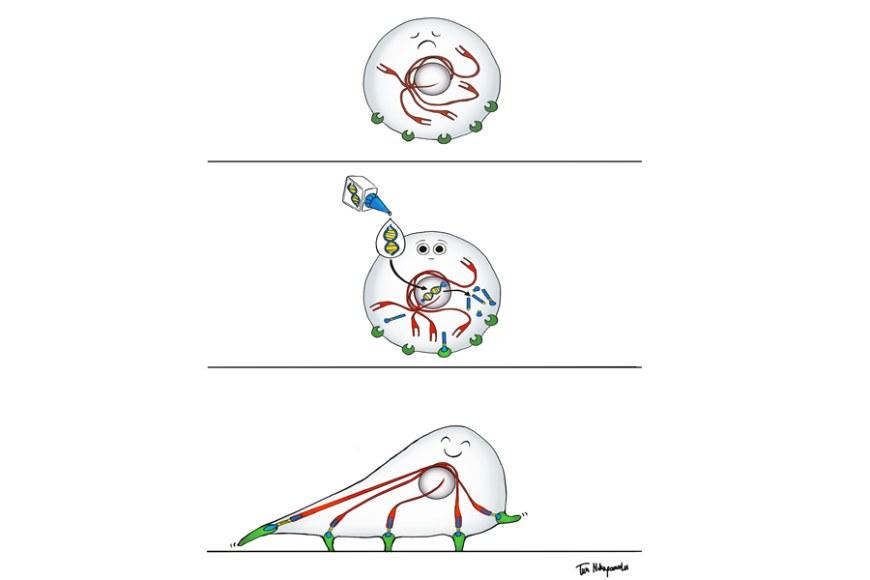
Menetelmän kehittivät Tampereen yliopiston tutkijat Paula Turkki ja Vesa Hytönen yhteistyössä Oxfordin yliopiston professori Mark Howarthin tutkimusryhmän kanssa. ”Pikaliiman” avulla voidaan pysyvästi, nopeasti ja tarkasti liittää proteiinimolekyylejä toisiinsa solun sisällä. Sidos toimii erittäin tehokkaana, molekylaarisena pikaliimana, jota solut voivat itse tuottaa.
Proteiinien väliset sidokset ovat usein heikkoja, mikä mahdollistaa proteiinien väliset vaihtuvat vuorovaikutukset, jotka ovat biologisen säätelyn perusta. Tamperelais-oxfordilaisessa tutkimuksessa kehitettyjen pysyvien sidosten avulla voidaan saada aikaan niin sanottuja pakotettuja vuorovaikutuksia, joista voi olla hyötyä niin lääketieteellisissä hoidoissa, diagnostiikassa, biomateriaalien luomisessa kuin rokotekehityksessäkin.
Aiemmin kehitettyjen ratkaisujen haasteina ovat olleet ei-toivotut vuorovaikutukset muiden proteiinien kanssa, sidoksen heikko kestävyys sekä hidas kohteen tunnistus, jonka vuoksi sidoksen osia on täytynyt käyttää ylimäärin, mikä on rajoittanut etenkin solunsisäisiä applikaatioita.
- Nyt kehitetyssä kolmannen sukupolven proteiini-peptidisidoksessa on useita etuja, mikä mahdollistaa sen laajemman käytön tulevaisuudessa, kertoo tutkijatohtori Paula Turkki Tampereen yliopistosta.
- Ensinnäkin sidoksen muodostavat komponentit koostuvat vain luonnollisista aminohapoista kuten muutkin elimistön proteiinit. Toiseksi ne kykenevät muodostamaan sidoksen erittäin pienellä määrällä sidoksen osia, ja niiden reaktionopeus on hyvin lähellä proteiinien luonnollista diffuusionopeutta, mikä tarkoittaa sitä, että sidos tapahtuu melkein niin nopeasti kuin vain luonnonlait sallivat, Turkki kertoo.
- Reaktion nopeuden ja tarkkuuden ansiosta sidoksen muodostavaa proteiiniparia täytyy tuottaa soluissa vain vähän, mikä mahdollistaa sen käytön solunsisäisissä reaktioissa mahdollisimman vähillä haittavaikutuksilla, Turkki lisää.
Nyt kehitetyn sidoksen kestävyyttä tutkittaessa solut ohjelmoitiin tuottamaan pikaliiman kaksi osaa siten, että ne yhdistyessään liittivät solun liikkumiselle tarpeellisen, mekaanisia voimia aistivan ja välittävän proteiinin toimivaksi kokonaisuudeksi. Molekylaarisella liimalla yhdistetty proteiini palautti soluille kyvyn liikkua ja liiman heikennetyillä versioilla solujen liikkumisnopeutta voitiin säädellä.
- Koeputkessa reaktiot ovat yleisesti helpommin toteuttavissa, kun taas solun sisällä, jossa on tuhansia erilaisia molekyylejä ja tapahtuu dynaamisia reaktioita, vaatimukset tarkkuuden ja kestävyyden suhteen ovat aivan erilaiset. Tutkimuksessa sidoksen osoitettiin muodostuvan suunnitellusti haluttujen proteiinien välille ja sidoksen näytettiin kestävän proteiiniin kohdistuvaa mekaanista rasitusta, toteaa Paula Turkki.
Tutkimuksessa suunniteltua molekyyliparia voidaan tulevaisuudessa hyödyntää erilaisissa bioteknologian ja biolääketieteen sovelluksissa, joissa tarvitaan proteiinien nopeaa ja kestävää sitoutumista ilman ei-toivottuja vuorovaikutuksia muiden molekyylien kanssa.
Tutkimusta rahoittivat Euroopan tutkimusneuvosto, Suomen Akatemia sekä Suomen Kulttuurirahasto.
Anthony H. Keeble, Paula Turkki, Samuel Stokes, Irsyad N. A. Khairil Anuar, Rolle Rahikainen, Vesa P. Hytönen ja Mark Howarth. Approaching infinite affinity through engineering of peptide–protein interaction. PNAS, https://www.pnas.org/
Lisätietoja:
Paula Turkki, paula.turkki [at] tuni.fi
Vesa Hytönen, vesa.hytönen [at] tuni.fi
TAMPEREEN YLIOPISTON TIEDOTE 9.12.2019
Piirros: Tiia Nikupaavola





